Wie bestimme ich die Molekülform eines Moleküls?
Antworten:
WARNUNG. Dies ist ein langes Dokument. Es deckt alle möglichen Formen für Moleküle mit bis zu sechs Elektronenpaaren um das Zentralatom ab.
Erläuterung:
SCHRITTE BETEILIGT
Es gibt drei grundlegende Schritte zur Bestimmung der Molekülform eines Moleküls:
-
Schreiben Sie die Lewis-Punkt-Struktur des Moleküls. Das gibt Ihnen die sterische Zahl (SN) - die Anzahl der Bindungspaare und Einzelpaare um das Zentralatom.
-
Verwenden Sie die SN und VSEPR Theorie zur Bestimmung der Elektronenpaargeometrie des Moleküls.
-
Verwenden Sie die VSEPR-Form, um die Winkel zwischen dem zu bestimmen Kleben Paaren.
VSEPR-PRINZIPIEN:
-
Die Abstoßung zwischen Valenzelektronenpaaren in der äußeren Hülle des Zentralatoms bestimmt die Form des Moleküls. Sie müssen die sterische Zahl (SN) bestimmen - die Anzahl der Bindungspaare und Einzelpaare um das Zentralatom.
-
Einsame Paare stoßen mehr ab als Bindungspaare.
A. SN = 2
Was ist die Form von #"BeCl"_2#?
Die Lewis-Punktstruktur für #"BeCl"_2# is

Die zentrale #"Be"# Atom hat zwei Bindungspaare in seiner äußeren Hülle (SN = 2).
Die Abstoßung zwischen diesen beiden Paaren bewirkt, dass die Atome so weit wie möglich voneinander entfernt sind.
Die Form des Moleküls ist linear und die #"Cl-Be-Cl"# Bindungswinkel ist 180 °.
B. SN = 3
Es gibt zwei Möglichkeiten.
i. #"AX"_3# - Drei Bindungspaare
Was ist die Form von #"BF"_3#?
Die Lewis-Punktstruktur #"BF"_3# is

Die #"B"# Atom hat drei Bindungspaare in seiner äußeren Hülle.
Die Minimierung der Abstoßung bewirkt die #"F"# Atome zu einem gleichseitigen Dreieck um die #"B"# Atom, wie unten gezeigt.

Die Form des Moleküls ist trigonal planar.
Alle Atome sind in der gleichen Ebene und die #"F-B-F"# Bindungswinkel sind alle 120 °.
ii. #"AX"_2"E"# - zwei Bindungspaare und ein einzelnes Paar
Was ist die Form von #"SO"_2#?
Die Lewis-Punktstruktur #"SO"_2# is

Das Zentralatom, #"S"#hat drei daran gebundene Gruppen, zwei Sauerstoffatome und ein einzelnes Paar.
Die Elektronenpaargeometrie von #"SO"_2# ist trigonal planar.
Es würde gezeichnet werden als

Die Molekülform von #"SO"_2# ist nicht trigonal planar.
Bei der Bestimmung der Molekülform berücksichtigen wir nur die Positionen der Atome, nicht die einzelnen Paare.
Daher ist die Molekülform von #"SO"_2# ist gebogen und wird dargestellt als

Das einzelne Elektronenpaar nimmt ein relativ großes Volumen ein, da es nur von einem Atom gehalten wird.
Sie komprimieren den Bindungswinkel zwischen Sauerstoff und Schwefel auf etwa 119.5 °.
C. SN = 4
Es gibt vier Möglichkeiten.
i. #"AX"_4# - vier Bindungspaare
Was ist die Form von #"CH"_4#?
Die Lewis-Punktstruktur #"CH"_4# is

Die Form dieses Moleküls ist jedoch nicht planar, wie Sie vielleicht anhand der Art und Weise denken, wie wir diese Punktstruktur zeichnen.
Die vier Bindungspaare sind um die #"C"# Atom, das auf die Ecken eines regulären Tetraeders zeigt.
Diese Form minimiert die Abstoßung zwischen den Bindungspaaren.

Der 109.5 ° -Winkel ist für alle gleich #"H-C-H"# Bindungswinkel und wird als tetraedrischer Bindungswinkel bezeichnet.
Die Form der #"CH"_4# Molekül ist tetraedrisch.
ii. #"AX"_3"E"# - drei Bindungspaare und ein einzelnes Paar.
Was ist der Molekulargeometrie of #"NH"_3#?
Die Lewis-Punktstruktur von #"NH"_3# is

Das Zentralatom, #"N"#hat vier Gruppen gebunden: drei Wasserstoffatome und ein einzelnes Paar.
Die Elektronenpaargeometrie von #"NH"_3# ist tetraedrisch.
Es wird wie folgt gezeichnet:

Denken Sie daran, dass wir bei der Bestimmung der Molekülform nur die Positionen der Atome berücksichtigen, nicht die einzelnen Paare.
Wenn wir nur die Atome betrachten, sehen wir ein kurzes, ziemlich verzerrtes Tetraeder.
Dies nennt man eine Pyramide.
Die #"NH"_3# Pyramide hat eine dreieckige Basis.
Daher ist die Form trigonal pyramidenförmig.
Die stärkere Abstoßung des Einzelpaares bewirkt die #"H"# Atome in #"NH"_3# enger zusammengebogen werden als der normale Tetraederwinkel von 109.5 °.
In #"NH"_3# das beobachtet #"H-N-H"# Bindungswinkel ist 107.3 °.
iii. #"AX"_2"E"_2# - zwei Bindungspaare und zwei Einzelpaare
Was ist die molekulare Geometrie von #"H"_2"O"#?
Die Lewis-Punktstruktur von #"H"_2"O"# is

Das Zentralatom, #"O"#hat vier daran gebundene Gruppen, zwei Wasserstoffatome und zwei einsame Paare.
Die Elektronenpaargeometrie von #"H"_2"O"# ist tetraedrisch.
Es wird wie folgt gezeichnet:

Die Form heißt gebogen.
Die #"H-O-H"# Bindungswinkel ist kleiner als der in #"NH"_3#teilweise wegen der größeren Abstoßung durch zwei einsame Paare.
In Wasser wird das beobachtet #"H-O-H"# Bindungswinkel ist 104.5 °.
Alle Bindungswinkel in #"AX"_2"E"_2# Moleküle sind signifikant kleiner als 109.5 °.
D. SN = 5
Es gibt vier Möglichkeiten.
i. #"AX"_5# - fünf Bindungspaare
Was ist die Molekülform von #"PCl"_5#?
Die Lewis-Punktstruktur von #"PCl"_5# is

Atome vorbei #"Si"# in das Periodensystem können "ihr Oktett erweitern" und mehr als acht haben Valenzelektronen.
Hier, die #"P"# Atom hat zehn Valenzelektronen.
Wenn Sie das anzeigen #"P"# Atom im Zentrum einer Kugel wie die Erde, haben Sie eine #"Cl"# Atom am Nordpol, einer #"Cl"# Atom am Südpol und drei #"Cl"# Atome verteilen sich gleichmäßig um den Äquator.

Beachten Sie, dass die #"Cl"# Atome besetzen zwei Arten von Positionen.
Die beiden #"Cl"# Atome, die sich auf einer geraden Linie befinden, die durch die #"P"# Kern sollen axiale Positionen einnehmen.
Die anderen drei #"Cl"# Atome befinden sich in äquatorialen Positionen.
Wenn Sie sich der #"Cl"# Atome durch gerade Linien, das Diagramm sieht aus wie zwei trigonale Pyramiden, die an der Basis miteinander verbunden sind.
Die #"PCl"_5# Molekül hat eine trigonale Bipyramidenform.
Es gibt zwei verschiedene Bindungswinkel im Molekül.
Die axiale #"Cl"# Atome haben einen Winkel von 90 ° zum Äquator #"Cl"# Atome, während das Äquatorial #"Cl"# Atome stehen in Winkeln von 120 ° zueinander.
ii. #"AX"_4"E"# - Vier Bindungspaare und ein einzelnes Paar.
Was ist die Molekülform von #"SF"_4#?
Die Lewis-Punktstruktur von #"SF"_4# is

Die fünf Elektronenpaare nehmen eine trigonale Bipyramidengeometrie an.

Das Einzelpaar nimmt eine äquatoriale Position ein, da es dadurch von den anderen Elektronenpaaren am weitesten entfernt ist.
Wenn Sie das Molekül auf die Seite drehen, sieht es aus wie eine Wippe mit der Achse #"F"# Atome an den Enden und das Äquatorial #"F"# Atome als Dreh- und Angelpunkt.
Die Form wird als Wippe bezeichnet.

Die axiale #"F–S–F"# Der Bindungswinkel ist 173.1 ° anstelle von 180 °, da sich in der Äquatorebene nur ein Elektronenpaar befindet.
Das Äquatorial #"F-S-F"# Der Bindungswinkel wird von seinem normalen Wert von 101.6 ° auf 120 ° komprimiert.
iii. #"AX"_3"E"_2# - Baumbindungspaare und zwei Einzelpaare
Was ist die Molekülform von #"ClF"_3#?
Die Lewis-Punktstruktur von #"ClF"_3# is
https://s3.amazonaws.com/classconnection/153/flashcards/919153/png/download_(3) -1518046CE7937FB18BB.png
Die fünf Elektronenpaare nehmen eine trigonale Bipyramidengeometrie an.

Die beiden einsamen Paare besetzen die Äquatorpositionen, um Abstoßungen zu minimieren.
Die Bindungspaare bilden eine T-Form, und das ist die Form des Moleküls.

Tatsächlich hat das Molekül eine "verzerrte T" -Form, weil die beiden Einzelpaare die #"F-S-F"# Bindungswinkel von 90 ° zu 86.98 ° und die #"F-S-F"# Der Bindungswinkel über der Oberseite des T wird von 180 ° auf 173.96 ° verringert.
iv. #"AX"_2"E"_3# - zwei Bindungspaare und drei Einzelpaare
Was ist die Molekülform von #"XeF"_2#?
Die Lewis-Punktstruktur von #"XeF"_2# is

Die fünf Elektronenpaare nehmen eine trigonale Bipyramidengeometrie an.
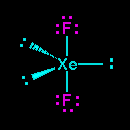
Die drei einsamen Paare besetzen die drei Äquatorpositionen. Sie haben also ein Xenonatom mit drei einsamen Paaren, die zu den Ecken eines gleichseitigen Dreiecks mit einem zeigen #"F"# Atom unter dem Dreieck und ein anderes darüber.
Das Ergebnis ist eine lineare Form für die #"XeF"_2# Molekül und die #"F-Xe-F"# Bindungswinkel ist 180 °.
E. SN = 6
Es gibt fünf Möglichkeiten.
i. #"AX"_6# - sechs Bindungspaare
Was ist die Molekülform von #"SF"_6#?
Die Lewis-Punktstruktur von #"SF"_6# is

Die sechs Bindungspaare ordnen sich mit vier äquatorialen Bindungspaaren und einem weiteren Paar an jeder der polaren Stellen an.

Die Form heißt oktaedrisch.
Jeden #"F-S-F"# Bindungswinkel ist 90 °.
ii. #"AX"_5"E"# - fünf Bindungspaare und ein einzelnes Paar
Was ist die Struktur von #"IF"_5#?
Die Lewis-Punktstruktur von #"IF"_5# is
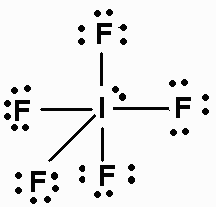
Die Elektronenpaare ordnen sich an den Ecken eines Oktaeders an, wobei ein einzelnes Paar eine dieser Positionen einnimmt.
Vier der #"F"# Atome befinden sich an den Ecken eines Quadrats, und eines befindet sich direkt über dem #"I"# Atom.
Linien verbinden die #"F"# Atome bilden eine Pyramide mit einer quadratischen Basis, die Form ist also quadratisch und pyramidenförmig.
Die #"F-I-F"# Winkel zwischen benachbarten #"F"# Atome sind 90 °.
iii. #"AX"_4"E"_2# - vier Bindungspaare und zwei Einzelpaare
Was ist die Molekülform von #"XeF"_4#?
Die Lewis-Punktstruktur ist

Die Elektronenpaare ordnen sich an den Ecken eines Oktaeders an.
Die vier Bindungspaare zeigen zu den Ecken eines Quadrats, und die einzelnen Paare nehmen die axialen Positionen oberhalb und unterhalb der Ebene des Quadrats ein.

Seit den vier #"F"# Atome befinden sich an den Ecken eines Quadrats, die Molekülform ist quadratisch planar.
Die #"F-Xe-F"# Bindungswinkel zwischen benachbarten #"F"# Atome sind 90 °.
iv. #"AX"_3"E"_3# - drei Bindungspaare und drei Einzelpaare
Es gibt keine Moleküle, die zu den gehören #"AX"_3"E"_3# System.
Die Elektronengeometrie ist jedoch oktaedrisch, wobei die drei Einzelpaare äquatoriale Positionen einnehmen.
Die verbleibenden Bindungspaare sind T-förmig mit Bindungswinkeln von 90 ° angeordnet.
![]()
v. #"AX"_2"E"_4# - zwei Bindungspaare und vier Einzelpaare
Kein Stall #"AX"_2"E"_4# Moleküle sind bekannt.
Wir sagen jedoch voraus, dass die Molekülform linear mit Bindungswinkeln von 180 ° ist.
![]()
ZUSAMMENFASSUNG
Um die Form eines Moleküls vorherzusagen:
-
Schreiben Sie die Lewis-Punkt-Struktur für das Molekül.
-
Bestimmen Sie die sterische Zahl des Zentralatoms.
-
Entscheiden Sie sich für die Elektronenpaarorientierung basierend auf der sterischen Zahl.
-
Berücksichtigen Sie die Platzierung einzelner Paare und eventuelle Verzerrungen durch "normale" Formen.
-
Nennen Sie die Form basierend auf der Position der Atome, die an das Zentralatom gebunden sind
In der folgenden Tabelle sind alle Molekülformen zusammengefasst.



