Welchen Trend in der Elektronegativität sehen Sie, wenn Sie eine Periode / Zeile im Periodensystem durchlaufen?
Antworten:
Antwort siehe unten.
Erläuterung:
Bevor ich weitermache, möchte ich erwähnen, dass es nicht nur so ist Elektronegativität Dies ist betroffen, wenn Sie eine Periode durchlaufen oder eine Gruppe auf- und absteigen. Die Ionisierungsenergie und der Atomradius schwanken ebenfalls.
Hier ist ein Diagramm:
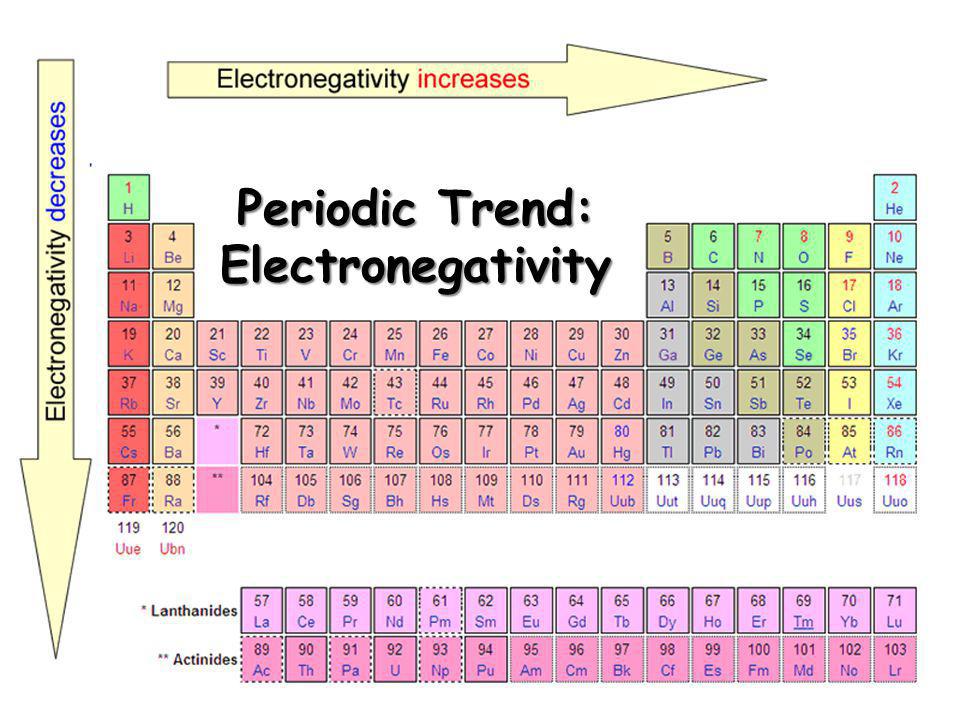
Wie Sie sehen, nimmt die Elektronegativität im Verlauf einer Periode zu, während die Elektronegativität im Verlauf einer Gruppe abnimmt. Wenn dies jedoch wahr ist (was es ist), können wir auch sagen, dass viele andere Faktoren auftreten, wie zum Beispiel:
-
Wenn Sie eine Periode von links nach rechts durchlaufen, nimmt die Elektronegativität zu, die Ionisierungsenergie nimmt zu und der Atomradius nimmt ab. Damit die Energie zunimmt, muss der Radius abnehmen.
-
Wenn Sie eine Periode auf und ab gehen, nimmt die Elektronegativität ab, die Ionisierungsenergie nimmt ab und der Atomradius nimmt zu. Damit die Energie abnimmt, muss der Radius zunehmen.
-
Die Elektronegativität ist die Kraft / Energie, die erforderlich ist, um bei chemischen Reaktionen Elektronen aufzunehmen und negative Ionen zu bilden. (Definition Kredit: von meinem Computer-Wörterbuch).
-
Ionisationsenergie ist das genaue Gegenteil. Die Ionisierung ist die Kraft / Energie, die erforderlich ist, um Elektronen aus einem Ion zu entfernen. Diese streben danach, Kationen zu bilden, während elektronegative Ionen normalerweise Anionen beinhalten (daher der Ausdruck Elektronegativität).

