Wie bewerte ich die folgenden Verbindungen vom niedrigsten bis zum höchsten Siedepunkt: Calciumcarbonat, Methan, Methanol (CH₄O), Dimethylether (CH₃OCH₃)?
Antworten:
Die Reihenfolge der Siedepunkte ist: #"CH"_4 < "CH"_3"OCH"_3 < "CH"_4"O" < "CaCO"_3#
Erläuterung:
Die Reihenfolge der Stärken intermolekularer Kräfte ist: #"ion-ion > H-bonding > dipole-dipole > London dispersion"#.
Verbindungen mit stärkeren intermolekularen Kräften haben höhere Siedepunkte.
Die stärkste intermolekulare Kraft in jeder der Verbindungen ist:
#"CaCO"_3# - Ionen-Ionen-Attraktionen.
#"CH"_4# - Londoner Zerstreuungskräfte
#"CH"_3"OH"# - Wasserstoffbrückenbindung
#"CH"_3"OCH"_3# - Dipol-Dipol-Attraktionen
#"CaCO"_3# ist eine ionische Verbindung. Es hat die höchsten Siedepunkte
Als nächstes kommt Methanol, #"CH"_4"O"# or #"CH"_3"OH"#.
Methanol hat stark Wasserstoffbrücken. Es hat den nächsthöheren Siedepunkt.
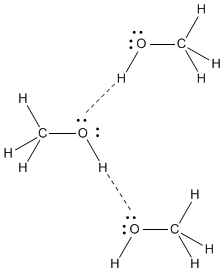
Dimethylether, #"CH"_3"OCH"_3#ist ein polares Molekül.
Die #"C-O"# Bindungsdipole verstärken sich gegenseitig, so dass das Molekül ein Dipolmoment hat.
Dipol-Dipol-Kräfte sind nicht so stark wie Wasserstoffbrücken, daher hat Dimethylether einen niedrigeren Siedepunkt als Methanol.
Schließlich wird das #"C-H"# Bindungen in Methan sind unpolar, daher ist das Molekül auch unpolar.
Es hat nur schwache Londoner Zerstreuungskräfte,

#"CH"_4#hat den niedrigsten Siedepunkt.
Die Reihenfolge der Siedepunkte ist:
#"CH"_4 < "CH"_3"OCH"_3 < "CH"_4"O" < "CaCO"_3#
Hier ist ein gutes Video zum Ordnen von Verbindungen nach ihren intermolekularen Kräften und Siedepunkten.

