Wie würden Sie die Ordnungszahl, Atommasse, Protonen, Neutronen und Elektronen für Ionen und Isotope finden? Ist es ähnlich
Antworten:
Sie verwenden das Periodensystem, um die erforderlichen Informationen abzurufen.
Erläuterung:
Das Symbol für ein Isotop eines Elements wie #"O"# wird oft geschrieben als #""_8^16"O"^n#.
-
Die #"O"# ist natürlich das Symbol für ein Sauerstoffatom.
-
Der Index repräsentiert die Ordnungszahl #Z#, die Anzahl der Protonen im Kern.
-
Der hochgestellte Text oben links steht für Massenzahl #A#die Gesamtzahl der Protonen und Neutronen im Kern.
-
Der hochgestellte Buchstabe oben rechts gibt die Ladung auf dem Ion an (z. B. + 1 oder -2).
-
Wenn es oben rechts keinen hochgestellten Index gibt, ist die Ladung Null und wir haben ein neutrales Atom.
Wie viele Protonen, Neutronen und Elektronen enthält ein Quecksilber-201-Atom?
Zuerst müssen Sie das Element in der finden Periodensystem.
Alle Periodensysteme geben mindestens das Symbol und die Ordnungszahl des Elements an.
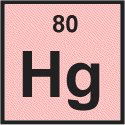
Wir sehen das für Quecksilber Ordnungszahl ist 80.
Die Ordnungszahl ist die Anzahl der Protonen im Atomkern, sodass wir sofort erkennen können, dass ein Quecksilberatom enthält 80-Protonen.
Die Massenzahl (201) ist die Gesamtzahl der Protonen und Neutronen.
Es muss also 201 - 80 = geben 121-Neutronen.
Da Atome elektrisch neutral sind, müssen so viele Elektronen wie Protonen vorhanden sein.
Ein Quecksilberatom braucht 80-Elektronen um die 80-Protonen auszugleichen.
Zusammengefasst:
- Anzahl der Protonen = Ordnungszahl #Z#
- Anzahl der Elektronen = Ordnungszahl #Z#
- Anzahl der Neutronen = Massenzahl - Ordnungszahl = #A – Z#
Wie viele Protonen, Neutronen und Elektronen sind in #""_80^200"Hg"^(2+)#?
Hier haben wir 80-Protonen und 200 - 80 = 120-Neutronen.
Die "2 +" - Ladung sagt uns, dass wir zwei Elektronen verloren haben.
Es gibt also 80 - 2 = 78-Elektronen.
Daher ist der Prozess sowohl für Isotope als auch für Ionen ähnlich.

