Wie wirkt sich Druck auf die Reaktionsgeschwindigkeit aus?
Durch Erhöhen des Drucks auf eine Reaktion, an der reagierende Gase beteiligt sind, wird die Reaktionsgeschwindigkeit erhöht. Das Ändern des Drucks auf eine Reaktion, an der nur Feststoffe oder Flüssigkeiten beteiligt sind, hat keinen Einfluss auf die Geschwindigkeit.
Wenn Sie den Druck eines Gases erhöhen, quetschen Sie es auf ein kleineres Volumen.
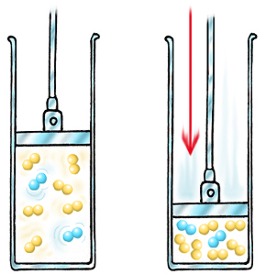
Damit eine Reaktion stattfinden kann, müssen die Partikel zuerst kollidieren. Wenn sich mehr Moleküle in einem kleineren Volumen befinden, ist die Wahrscheinlichkeit einer Kollision größer und die Rate steigt.
Das Volumen von Feststoffen und Flüssigkeiten ändert sich nicht mit dem Druck.
Eine Erhöhung des Drucks auf Feststoffe und Flüssigkeiten hat keinen Einfluss auf die Reaktionsgeschwindigkeit.

