Wie unterscheiden sich Lewis-Säuren und -Basen von Bronsted / Lowry-Säuren und -Basen?
Antworten:
Lewis-Säuren und -Basen sind definiert als die Fähigkeit, Elektronenpaare aufzunehmen oder abzugeben. Während Bronsted-Lowry-Säuren und -Basen definiert sind als die Fähigkeit, Wasserstoffionen aufzunehmen oder abzugeben (#H^(+)#).
Erläuterung:
• Eine Brønsted-Lowry-Säure ist jede Substanz (Molekül oder Ion), die ein Wasserstoffion abgeben kann (#H^(+)#).
• Eine Brønsted-Lowry-Base ist jede Art, die ein Wasserstoffion aufnehmen kann (#H^(+)#).
#color(blue) ("Take the reaction below for example:")#
#HNO_2+ H_2O rightleftharpoons H_3O^(+) + NO_2^(-)#
Salpetersäure (#HNO_2#) ist die Brønsted-Lowry-Säure, weil sie ein Wasserstoffion an Wasser abgibt. Wasser ist die Brønsted-Lowry-Base, weil es das Wasserstoffion aufnimmt.
#color(red)("On the other hand")#Lewis-Säuren und -Basen sind entweder als Elektronenpaardonor oder als Elektronenpaarakzeptor definiert.
• Eine Lewis-Säure ist als Elektronenpaarakzeptor definiert. Dies bedeutet, dass Säuren ein einzelnes Elektronenpaar von einer Lewis-Base aufnehmen können, da die Säure leere Valenzorbitale aufweist.
• Eine Lewis-Säure muss ein freies Valenzorbital haben und es kann sich um ein Kation handeln, z #Al^(3+)#oder ein neutrales Molekül, wie z #CO_2#.
• Eine Lewis-Base ist ein Elektronenpaardonor. Dies bedeutet, dass eine Lewis-Base zwei ihrer Elektronen an eine Lewis-Säure abgeben kann.
Hier ist eine allgemeine Darstellung einer Lewis-Säure-Base-Reaktion:
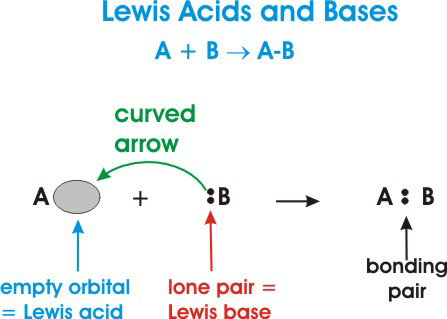
Im obigen Diagramm #A# ist eine Lewis-Säure, weil sie ein Elektronenpaar aufnimmt #B# wie durch den gekrümmten Pfeil angegeben.
#B# ist eine Lewis-Base, an die sie ihre Elektronen spendet #A#.

