Wie kann ich die Lewis-Struktur für ClO2- zeichnen?
Antworten:
So würde ich es machen.
Erläuterung:
Sie können die Prozedur finden hier.
Für #"ClO"_2^"-", "Cl"# ist das weniger elektronegative Atom. So, #"Cl"# ist das Zentralatom
Die Skelettstruktur ist #"O-Cl-O".#
Die Versuchsstruktur ist

Du hast 20 Valenzelektronen in Ihrer Versuchsstruktur.
Die Valenzelektronen Sie haben zur Verfügung stehen: #"1 Cl + 2 O + 1 e" = 1×7 + 2×6 + 1 = 20#.
Daher hat die Versuchsstruktur die richtige Anzahl von Elektronen.
Die formale Ladung für jedes Atom ist:
#"Cl" = 7 - 4 - ½(4) = +1; "O" = 6 – 6 - ½(2) = "-1"#
Jedes Atom hat eine formale Ladung.
Wir können die Anzahl der formalen Ladungen reduzieren, indem wir ein einzelnes Elektronenpaar entfernen #"O"# eine Form #"Cl=O"# Doppelbindung.
Dies gibt uns zwei neue Strukturen, in denen eine #"O"# Atom hat #"FC = -1"# und die anderen Atome haben #"FC = 0"#:
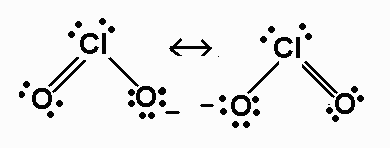
Die tatsächliche Struktur ist neun davon. Vielmehr handelt es sich um einen Resonanz-Hybrid von beiden


