Welche Gruppe ist oxidierter, # -CHO # oder # -CH_2OH # und warum?
Antworten:
Die #"-CHO"# Gruppe ist mehr oxidiert.
Erläuterung:
Es gibt drei Methoden, mit denen wir den relativen Oxidationsgrad bestimmen können.
1. Unter Verwendung der Oxidationszahl des Kohlenstoffatoms
Eine Definition von Oxidation ist: eine Erhöhung der Oxidationszahl.
Berechnen wir die Oxidationszahl von #"C-1"# im ethanal.

Nach den Regeln für die Berechnung der Oxidationszahlen, #"C-1"# "besitzt" eines der Elektronen in der #"C-C"# Bindung, beide Elektronen in der #"C-H"# Bindung, und keines der Elektronen in der #"C=O"# Bindung.
Da #"C-1"# "besitzt" nur drei Valenzelektronen, es hat effektiv ein Elektron "verloren", daher hat es eine Oxidationszahl von + 1.
Nun wiederholen wir den Vorgang für #"C-1"# in Ethanol.
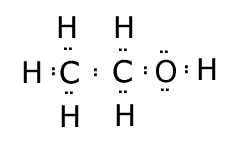
Hier #"C-1"# "besitzt" eines der Elektronen in der #"C-C"# Bindung, beide Elektronen in der #"C-H"# Bindungen, und keines der Elektronen in der #"C=O"# Bindung.
Da #"C-1"# Jetzt "besitzt" es fünf Valenzelektronen und hat effektiv ein Elektron "gewonnen", so dass es eine Oxidationszahl von -1 hat.
Der Aldehydkohlenstoff hat eine höhere Oxidationszahl als der Alkoholkohlenstoff, so dass a #"CHO"# Gruppe ist stärker oxidiert als a #"CH"_2"OH"# Gruppe.
2. Durch Zählen der Anzahl der Sauerstoffatome
Eine zweite Definition von Oxidation ist: eine Zunahme der Anzahl der Sauerstoffatome.
Beide Gruppen enthalten ein O-Atom, aber das O im Aldehyd ist doppelt gebunden, so dass wir es zweimal zählen können (wie wir es bei der Bestimmung tun) #R,S# Konfigurationen).
Somit wird die #"CHO"# Gruppe ist stärker oxidiert als die #"CH"_2"OH"# Gruppe.
3. Durch Zählen der Anzahl der Wasserstoffatome
Eine dritte Definition von Oxidation ist: eine Abnahme der Anzahl der Wasserstoffatome.
#"C-1"# in der Alkoholgruppe sind zwei H-Atome gebunden, während #"C-1"# in der Aldehydgruppe ist ein H-Atom gebunden.
deshalb, die #"CHO"# Gruppe ist stärker oxidiert als die #"CH"_2"OH"# Gruppe.

