Welche Art intermolekularer Kräfte sind in den folgenden Verbindungen vorhanden: #C Cl_4 #, # CH_2Cl_2 #, # CH_3OH #, # CO_2 #, # SCl_4 # und # SCl_6 #?
Warnung! Lange Antwort. Folgendes bekomme ich.
Sie müssen die Lewis-Struktur jedes Moleküls zeichnen, seine Form mithilfe der VSEPR-Theorie bestimmen und dann entscheiden, ob die Bindung besteht oder nicht Dipole stornieren.
#"CO"_2# und #"CCl"_4#

(Von www.peoi.org)
#"CO"_2# ist ein lineares Molekül mit einer #"O-C-O"# Bindungswinkel von 180 °. Die Bindungsdipole sind gleich und in entgegengesetzte Richtungen, so dass sie sich aufheben.
#"CO"_2# ist ein unpolares Molekül. Seine stärksten intermolekularen Kräfte sind Londoner Zerstreuungskräfte.
#"CCl"_4# ist ein tetraedrisches Molekül mit a #"Cl-C-Cl"# Bindungswinkel von 109.5 °.
Die beiden #"C-Cl"# Bindungsdipole in der Papierebene weisen in einem Winkel von 54.75 ° zur Vertikalen nach rechts.
Die beiden #"C-Cl"# Bindungsdipole hinter und vor dem Papier haben das gleiche und entgegengesetzte Ergebnis wie das erste.
Da die Bindungsdipole gleich und gegenläufig sind, heben sie sich auf.
#"CCl"_4# ist ein unpolares Molekül. Seine stärksten intermolekularen Kräfte sind Londoner Zerstreuungskräfte.
#"CH"_2"Cl"_2#
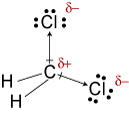
#"CH"_2"Cl"_2# hat eine tetraedrische Form. Die Zwei #"C-Cl"# Bindungsdipole haben eine Resultierende, die die #"Cl-C-Cl"# Bindungswinkel.
#"CH"_2"Cl"_2# ist daher ein polares Molekül und seine stärksten intermolekularen Kräfte sind Dipol-Dipol-Kräfte.
#"CH"_3"OH"#
#"CH"_3"OH"# hat eine sehr polare #"O-H"# Bindung. Das #"O"# Atom hat ein Hoch #δ^"-"# aufladen, und die #"H"# dauert ebenfalls 3 Jahre. Das erste Jahr ist das sog. #"OH"# hat ein Hoch #δ^+# Ladung.
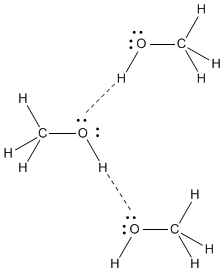
Die #"O"# in einem Molekül ist stark von dem angezogen #"H"# in einem anderen Molekül und dem #"H"# in einem Molekül ist stark von dem angezogen #"O"# in einem anderen Molekül.
Die stärkste intermolekulare Kraft in #"CH"_3"OH"# is Wasserstoffbrückenbindung.
#"SCl"_4#

(Von en.wikipedia.org)
#"SCl"_4# hat eine Wippeform.
Die zwei waagerecht #"S-Cl"# Bindungsdipole heben sich auf, aber die nach unten weisenden Dipole verstärken sich gegenseitig.
#"SCl"_4# ist ein polares Molekül und seine stärksten intermolekularen Kräfte sind Dipol-Dipol-Kräfte.
#"SCl"_6#
#"SCl"_6#ist ein oktaedrisches Molekül.
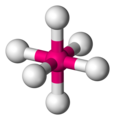
Jeden #"S-Cl"# Bindungsdipol hat einen Partner, der genau in die entgegengesetzte Richtung zeigt, sodass sich alle Bindungsdipole aufheben.
#"SCl"_6# ist ein unpolares Molekül, daher sind seine stärksten intermolekularen Kräfte Londoner Zerstreuungskräfte.

