Was sind die Bindungswinkel im Zentralatom von: # "NSF" #, # "OF" _2 # und # "IBr" _2 ^ - "#?
Antworten:
Die Bindungswinkel sind etwas kleiner als 120 °, etwas kleiner als 109.5 ° bzw. 180 °.
Erläuterung:
#bb"NSF"#
Die Struktur #"NSF"# is
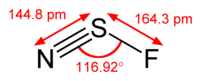
Es gibt ein einzelnes Paar auf der #"N"# Atom, ein einzelnes Paar auf der #"S"# Atom, und es gibt drei einsame Paare auf der #"F"# Atom.
Das ist ein #"AX"_2"E"# Molekül, so ist die Elektronengeometrie trigonal planar und die Molekülform ist gebogen.
Der theoretische Bindungswinkel beträgt 120 °, aber die Abstoßung durch die einzelnen Paare verringert den Bindungswinkel auf etwa 117 °.
#bb"OF"_2#
Die Lewis-Struktur von #"OF"_2# is

Das ist ein #"AX"_2"E"_2# Molekül, so ist die Elektronengeometrie tetraedrisch und die Molekülform ist gebogen.
Der theoretische Bindungswinkel beträgt 109.5 °, aber Abstoßungen durch die einzelnen Paare verringern den Bindungswinkel auf etwa 103 °.

#bb"IBr"_2^-#
Die Lewis-Struktur von #"IBr"_2^-# is
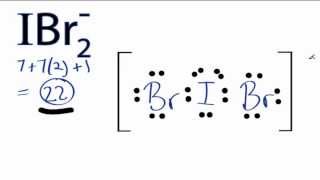
Das ist ein #"AX"_2"E"_3# Struktur, so ist die Elektronengeometrie trigonal bipyramidal.

Die einsamen Paare besetzen die äquatorialen Positionen mit dem #"Br"# Atome in den axialen Lagen.
Der Bondwinkel beträgt 180 °.

