Was ist der Unterschied zwischen bindenden und antibindenden Molekülorbitalen?
Antworten:
Orbitale verbinden Platzieren Sie den größten Teil der Elektronendichte zwischen den Kernen der gebundenen Atome.
Antibonding Orbitale platzieren den größten Teil der Elektronendichte außerhalb der Kerne.
Erläuterung:
Elektronen in Orbitale binden stabilisieren das Molekül, weil sie zwischen den Kernen sind.
Sie haben auch niedrigere Energien, weil sie näher an den Kernen sind.
Antibondierende Orbitale platziere weniger Elektronendichte zwischen den Kernen.
Die nuklearen Abstoßungen sind größer, so dass die Energie des Moleküls zunimmt.
Antibindende Orbitale haben ein höheres Energieniveau als bindende Orbitale.

Antibindende Sigma-Orbitale haben höhere Energieniveaus und eine geringere Elektronendichte zwischen den Kernen.
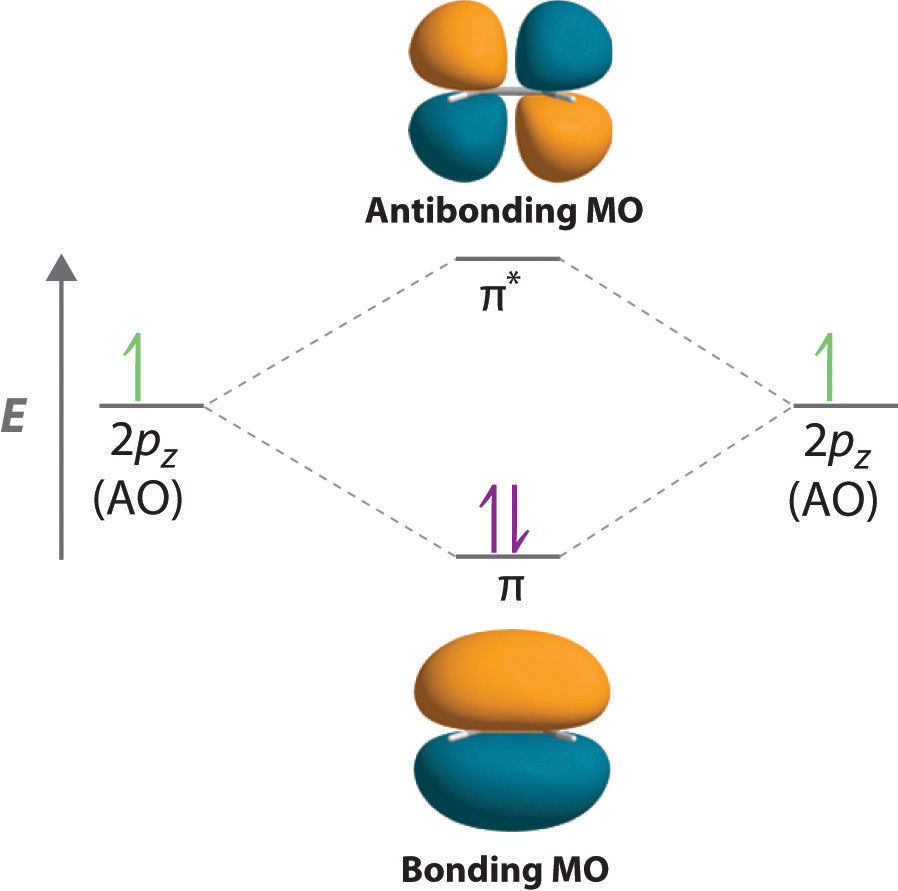
Antibindende Pi-Orbitale haben höhere Energieniveaus und eine geringere Elektronendichte zwischen den Kernen.

