In welcher Beziehung stehen pi- und sigma-Bindungen zur Hybridisierung?
Antworten:
Die meisten Atome hybridisieren ihre s- und p-Atomorbitale, um die stabilsten Molekülorbitale zu erhalten.
Erläuterung:
Die Valenzschale eines Atoms besteht aus einem s-Orbital und drei p-Orbitalen.
Wenn sich zwei s-Orbitale überlappen, bilden sie eine σ-Bindung.
Wenn sich zwei p-Orbitale Seite an Seite überlappen, bilden sie eine π-Bindung.

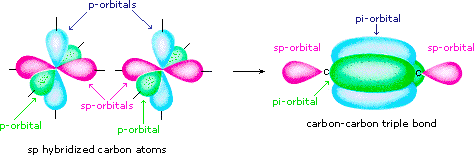
s- und p-Orbitale können unterschiedliche Hybridisierungen bilden.
s + p → sp
s + p + p → sp²
s + p + p + p → sp³
Wenn sich zwei hybridisierte Orbitale überlappen, bilden sie eine σ-Bindung.
sp³-hybridisierte Atome verwenden alle drei p-Orbitale für die Hybridisierung. Dies bedeutet, dass sich nur sp³ hybridisierte Atome bilden können Sigma-Anleihen. Sie können keine Mehrfachbindungen eingehen.
sp²-hybridisierte Atome verwenden bei der Hybridisierung nur zwei p-Orbitale. Es ist ein unbenutztes p-Orbital vorhanden. Dieses übrig gebliebene p-Orbital kann eine π-Bindung mit einem anderen Atom eingehen und eine Doppelbindung bilden.

sp-hybridisierte Atome verwenden bei der Hybridisierung nur ein p-Orbital. Dies bedeutet, dass Sie zwei π-Bindungen erstellen können.