Frage #788a2
Das Schwefelatom in H & sub2; SO & sub3; weist eine sp³-Hybridisierung auf.
Um die Hybridisierung von S zu bestimmen, müssen Sie:
ein. Zeichnen Sie die Lewis-Struktur für H₂SO₃.
b. Bestimmen Sie die sterische Zahl (SN) des S-Atoms.
SN = BP + LP, wo
BP = Anzahl von Kleben Paare und
LP = Anzahl der Einzelpaare.
c. Weisen Sie die Hybridisierung zu, die der SN entspricht.
Die Lewis-Struktur von H₂SO₃ ist
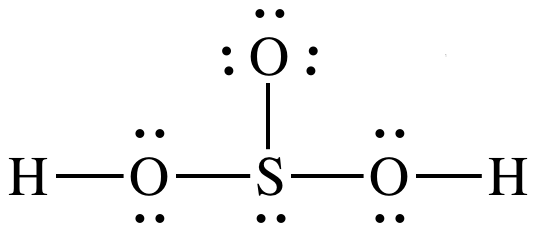
Es gibt drei Bindungspaare und ein einzelnes Paar am S-Atom, also SN = 4.
Die Hybridisierung, die verschiedenen sterischen Zahlen entspricht, ist
SN = 2; Hybridisierung = sp
SN = 3; Hybridisierung = sp²
SN = 4; Hybridisierung = sp³
SN = 5; Hybridisierung = sp³d
SN = 6; Hybridisierung = sp³d²
Wir sehen, dass SN = 4 der sp³-Hybridisierung für das S-Atom entspricht.

