# BeCl_2 # und # TeCl_2 # sind beide kovalente Moleküle, dennoch ist # BeCl_2 # linear, während # TeCl_2 # gebogen ist. Warum?
#"TeCl"_2#: Die Zentrale #"Te"# Atom hat #6# Valenzelektronen. Wenn die beiden #"Cl"# Atome binden an das Zentralatom, sie tragen jeweils ein Elektron zur Bildung von zwei bei Sigma-Anleihen. Diese Blätter #4# Elektronen an den Zentralatomen in Form von #2# einsame Elektronenpaare.
Dies ist die VSEPR gestalten #"AX"_2"E"_2#eine Tetraederform mit zwei Elektronenpaaren und zwei Atomen, wodurch eine gebogene Molekülform entsteht.
![]()
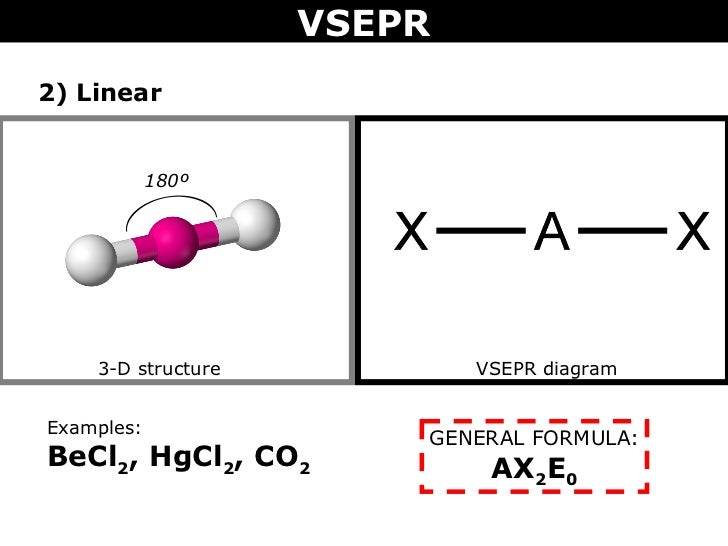
#"BeCl"_2#auf der anderen Seite hat #"Be"# als zentrales Atom. Schon seit #"Be"# hat nur #2# Valenzelektronen, die zwei Sigma - Bindungen, die von der #"Cl"# Atome verlassen #"Be"# ohne einsame Paare.
Die VSEPR-Form ist #"AX"_2"E"_0# und bildet eine lineare Form.