Wie unterscheidet sich das Wasserphasendiagramm von den meisten Substanzen?
Antworten:
Die Trennlinie zwischen fester und flüssiger Phase weist eine negative Steigung auf.
Erläuterung:
A Phasendiagramm ist ein Diagramm, das zeigt, welche Phasen bei einer bestimmten Temperatur und einem bestimmten Druck vorhanden sind.
Es hat normalerweise Druck auf der vertikalen Achse und Temperatur auf der horizontalen Achse.
Die durch die Linien getrennten Regionen geben den Zustand von an #T# und #P# Das heißt, es entsteht ein Gas, eine Flüssigkeit oder ein Feststoff.
Die Linien selbst repräsentieren die Kombinationen von #T# und #P# bei dem sich zwei Zustände im Gleichgewicht befinden.
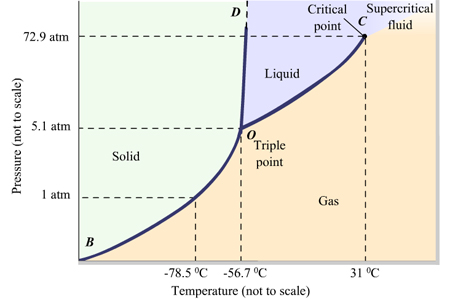
Das Phasendiagramm für die meisten Substanzen sieht so aus.
Das Phasendiagramm für Wasser sieht jedoch so aus.
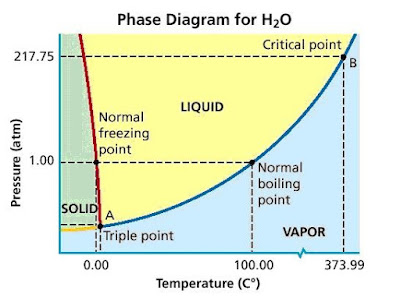
Erkennst du den Unterschied?
Normalerweise wie in #"CO"_2#die Fest / Flüssig-Phasenlinie OD hat eine positive Steigung.
Die entsprechende Linie im Wasser (die rote Linie) hat jedoch eine negative Steigung.
Wenn Sie den Druck erhöhen, wird die Dichte einer Substanz steigt.
Somit zeigt die negative Steigung an, dass die flüssige Phase eine größere Dichte als die feste Phase aufweist.
Mit anderen Worten, die Dichte von Eis ist geringer als die von Wasser.
Bei den meisten anderen üblichen Substanzen ist der Feststoff dichter als die Flüssigkeit.

