Woher kennen Sie die Hybridorbitale einer Verbindung? Was sind beispielsweise die Hybridorbitale von # CH_2Cl_2 #, # C_2H_4 # und # C_2H_2 #?
Antworten:
Die Hybridorbitale in #"CH"_2"Cl"_2, "C"_2"H"_4#, und #"C"_2"H"_2# sind #"sp"^3, "sp"^2^#, und #"sp"#, Bzw.
Erläuterung:
In jedem Fall müssen Sie die Lewis-Struktur zeichnen, die VSEPR-Geometrie bestimmen und dann die entsprechende Hybridisierung zuweisen.
#"CH"_2"Cl"_2#:
Die Lewis-Struktur von #"CH"_2"Cl"_2# is

Es gibt vier Elektronendomänen um das Kohlenstoffatom, so wie es die Elektronengeometrie ist tetraedrisch.

Die Hybridisierung, die einer tetraedrischen Geometrie entspricht, ist #"sp"^3#.

#"C"_2"H"_4#:
Die Lewis-Struktur von #"C"_2"H"_4# is
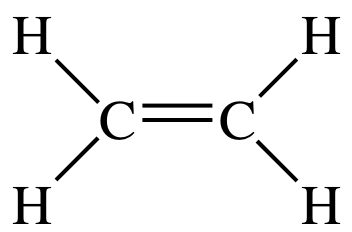
Es gibt drei Elektronendomänen um jedes Kohlenstoffatom, die Elektronengeometrie ist also trigonaler Planar.
Die Hybridisierung, die einer trigonalen planaren Geometrie entspricht, ist #"sp"^2#.

#bb"sp"#
Die Lewis-Struktur von #"C"_2"H"_2# is

Es gibt zwei Elektronendomänen um jedes Kohlenstoffatom, die Elektronengeometrie ist also linear.

Die Hybridisierung, die einer trigonalen planaren Geometrie entspricht, ist #"sp"#.

(Aus Learnnext)

