Wie wirken sich Resonanzstrukturen auf den Säuregehalt aus?
Antworten:
Kurze Antwort: Resonanz Strukturen, die eine konjugierte Base stabilisieren, erhöhen den Säuregehalt.
Erläuterung:
Beachten Sie die Säuren von Methanol und Essigsäure.
CH₃OH + H₂OO CH₃O⁻ + H₃O⁺; #pK_"a"# = 15
CH₃COOH + H₂OO CH₃COO⁻ + H₃O⁺; #pK_"a"# = 5
Warum ist Essigsäure #10^10# mal so sauer wie Methanol?
Antworten: Hier ist meine Erklärung.
Im Methoxidion ist die negative Ladung am Sauerstoffatom lokalisiert (konzentriert).
Resonanz stabilisiert sowohl Essigsäure als auch Acetation,
In Essigsäure ist die Stabilisierung gering, da der Resonanzbeitrag eine Ladungstrennung beinhaltet.
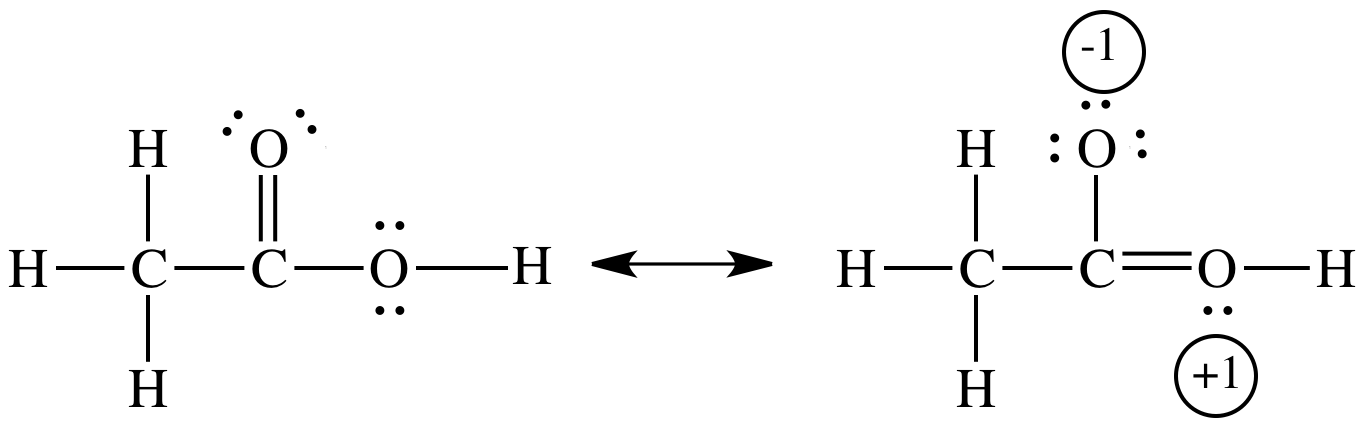
Im Acetation gibt es keine Ladungstrennung.
Stattdessen wird die negative Ladung über drei Atome delokalisiert (verteilt). Diese Delokalisierung erzeugt einen energiearmen Zustand.
Sind die Reaktionsprodukte stabiler als die Reaktanten, liegt die Gleichgewichtslage rechts.
Die Resonanzstabilisierung des Acetations macht Essigsäure saurer als Methanol.
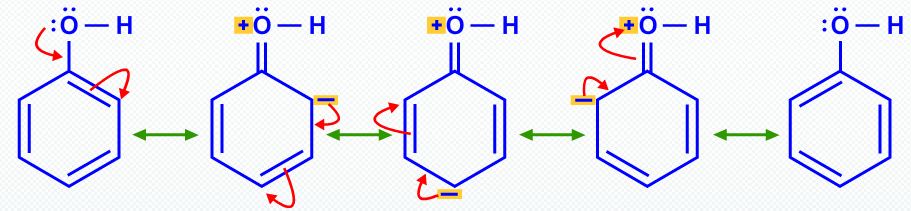
In gleicher Weise macht Resonanz Phenol saurer als Ethanol.
Es gibt keine Resonanzstabilisierung im Ethoxidion.
#"CH"_3"CH"_2"OH" + "H"_2"O" ⇌ "CH"_3"CH"_2"O"^"-" + "H"_3"O"^"+"; "p"K_text(a) = 17#
Resonanz stabilisiert sowohl Phenol- als auch Phenoloxidionen durch Delokalisierung von Elektronen in den Ring.
Diese & dgr; -Lokalisierung in Phenol beinhaltet jedoch eine Ladungstrennung und macht das Sauerstoffatom positiv.
Die gleiche Delokalisierung im Phenoxidion sorgt für eine viel stärkere Stabilisierung, da keine Ladungstrennung stattfindet.

Die Gleichgewichtslage liegt rechts. #"p"K_text(a) = 10#.
Somit ist Phenol #10^7# mal so sauer wie Ethanol, weil Resonanz das Phenoxidion stabilisiert.