Wie skizziert man galvanische Zellen?
Sie zeichnen die Anode, die Kathode, die Oxidations- und Reduktionsmittel, eine poröse Platte oder eine Salzbrücke. Sie zeigen die Richtung des Elektronenflusses im externen Stromkreis und den Ionenfluss im internen Stromkreis.
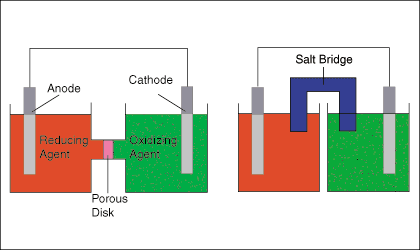
BEISPIEL:
Skizzieren Sie ein Zelldiagramm für die Reaktion
Zn (s) + Cu² & spplus; (aq) → Zn² & spplus; (aq) + Cu (s)
Lösung:
A. Zeichnen Sie eines der obigen Diagramme (keine Beschriftung).
B. Identifizieren Sie, was oxidiert und reduziert wird.
Zn wird oxidiert; Cu²⁺ wird reduziert.
C. Legen Sie die Oxidationsmaterialien in die linke Zelle. Beschriften Sie das Zn als negative Anode. In die Lösung geben Sie Zn²⁺ und NO₃ put.
D. Die Reduktionshalbreaktionsmaterialien in die rechte Zelle geben. Kennzeichnen Sie das Cu als positive Kathode. In die Lösung Cu²⁺ und entweder SO⁻²₄ oder NO₃⁻ geben.
E. Legen Sie ein Salz wie KNO₃ in die Salzbrücke.
F. Verwenden Sie die Pfeile, um den Elektronenfluss im externen Draht anzuzeigen.

G. Zeigen Sie den Ionenfluss im internen Kreislauf an.
Die Kationen - Zn² & spplus ;, Na & spplus; und Cu² & spplus; - bewegen sich von links nach rechts. Die NO & sub3; & sub0; -Anionen bewegen sich von rechts nach links. Zeichnen Sie Pfeile, um diese Bewegungen anzuzeigen.

