Wie reagieren Amine und Amide?
Ein Amin ist eine mit Ammoniak verwandte organische Verbindung, die ein Stickstoffatom enthält, das an eine oder mehrere Alkylgruppen an jedem Molekül gebunden ist

#"Primary amine"#

#"an example of Secondary amine"#

#"Tertiary amine"#

Stickstoffatome, die Teil eines aromatischen Rings sind, haben eine planare Konfiguration (sp2-Konfiguration) und keine stereogenen Zentren. Aufgrund der Aromatizität sind Amine in aromatischen Ringen stabil.
Als Hybrid des Stickstoffs wirkt seine Kraft als Säure und Base.
Ein höherer Stickstoffcharakter macht die Verbindung beispielsweise in Pyridin und Nitrilen sauer.
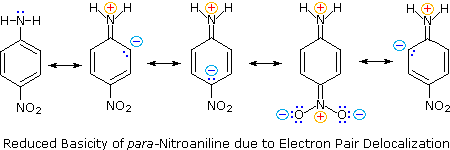
Zweitens sind Anilin und p-Nitroanilin schwächere Basen aufgrund der Delokalisierung des nichtbindenden Stickstoffelektronenpaars in den aromatischen Ring (und den Nitrosubstituenten). Dies ist die gleiche Delokalisierung, die zur Aktivierung eines Benzolrings zur elektrophilen Substitution führt.
Die folgenden Resonanzgleichungen, die den zur Erklärung der erhöhten Acidität von ortho- und para-Nitrophenolen verwendeten ähnlich sind, veranschaulichen die Elektronenpaardelokalisierung in p-Nitroanilin.
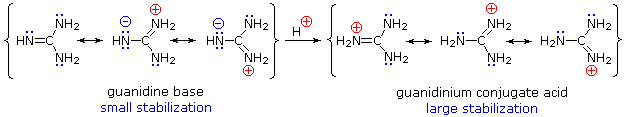
Obwohl Resonanzdelokalisierung im Allgemeinen die Basizität von Aminen verringert, findet sich ein dramatisches Beispiel für den umgekehrten Effekt in der Verbindung Guanidin (pKa = 13.6).
Amine sind größtenteils basisch, aber einige haben aus diesen Gründen eine verringerte Basizität
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Bei der Reaktion mit Säuren spenden Amine Elektronen, um Ammoniumsalze zu bilden.

Säurehalogenide reagieren mit Aminen unter Bildung substituierter Amide

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Herstellung von Schiffschen Basen aus primären Aminen
Aldehyde und Ketone reagieren mit primären Aminen zu einem Reaktionsprodukt (einem Carbinolamin), das zu Aldiminen und Ketiminen (Schiff-Basen) dehydratisiert.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Wenn Sie sekundäre Amine mit Aldehyden oder Ketonen umsetzen, bilden sich Enamine.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Amine reagieren mit Sulfonylchloriden unter Bildung von Sulfonamiden. Ein typisches Beispiel ist die Umsetzung von Benzolsulfonylchlorid mit Anilin.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Der Hinsberg-Test
Der Hinsberg-Test, der primäre, sekundäre und tertiäre Amine unterscheiden kann, basiert auf der Sulfonamidbildung. Im Hinsberg-Test wird ein Amin mit Benzolsulfonylchlorid umgesetzt. Wenn sich ein Produkt bildet, ist das Amin entweder ein primäres oder ein sekundäres Amin, weil tertiäre Amine keine stabilen Sulfonamide bilden. Löst sich das entstehende Sulfonamid in wässriger Natronlauge, so handelt es sich um ein primäres Amin. Wenn das Sulfonamid in wässrigem Natriumhydroxid unlöslich ist, ist es ein sekundäres Amin. Das Sulfonamid eines primären Amins ist in einer wässrigen Base löslich, da es am Stickstoff noch einen sauren Wasserstoff besitzt, der unter Bildung eines Natriumsalzes verloren gehen kann.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Oxidation von Aminen
Obwohl Sie alle Amine oxidieren können, ergeben nur tertiäre Amine leicht isolierte Produkte. Die Oxidation eines tertiären Amins führt zur Bildung eines Aminoxids.

Arylamine neigen dazu, leicht zu oxidieren, wobei Oxidation sowohl an der Amingruppe als auch im Ring auftritt.
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Reaktion mit salpetriger Säure
Salpetrige Säure ist instabil und muss in der Reaktionslösung durch Mischen von Natriumnitrit mit Säure hergestellt werden.
Primäre Amine reagieren mit salpetriger Säure zu einem Diazoniumsalz, das sehr instabil ist und zu einem Carbokation abgebaut wird, das mit jedem in Lösung befindlichen Nucleophil reagieren kann. Daher führt die Umsetzung von primären Aminen mit salpetriger Säure zu einem Gemisch aus Alkoholen, Alkenen und Alkylhalogeniden.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Primäre aromatische Amine bilden bei null Grad stabile Diazoniumsalze.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Sekundäre aliphatische und aromatische Amine bilden mit salpetriger Säure Nitrosoamin.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Tertiäre Amine reagieren mit salpetriger Säure unter Bildung von N-Nitrosoammoniumverbindungen.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Reaktionen aromatischer Diazoniumsalze
Diazoniumsalze aromatischer Amine sind als Zwischenprodukte für andere Verbindungen sehr nützlich. Da aromatische Diazoniumsalze nur bei sehr niedrigen Temperaturen (0 ° C und darunter) stabil sind, wird durch Erwärmen dieser Salze die Zersetzung in hochreaktive Kationen ausgelöst. Diese Kationen können mit jedem in Lösung vorhandenen Anion unter Bildung einer Vielzahl von Verbindungen reagieren. Die folgende Abbildung zeigt die Vielfalt der Reaktionen.

Ich werde über Amide in einer anderen Antwort auf diese Frage schreiben

