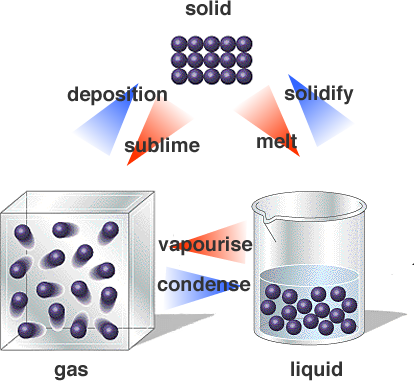
Wie können Zustandsänderungen durch die Partikeltheorie erklärt werden?
Wenn Partikel genug Energie gewinnen, können sie den Anziehungskräften ihrer Nachbarn entkommen und in einen flüssigeren Zustand übergehen.
Alle Teilchen ziehen sich an. Gleichzeitig sind alle Moleküle in ständiger Bewegung. Ihre kinetischen Energien treiben sie auseinander.
Bei niedrigen Temperaturen ist die kinetische Energie der Moleküle gering. Die Partikel können sich nicht schnell genug bewegen, um den Attraktionen ihrer Nachbarn zu entkommen. Sie sind „eingeklebt“, so dass sie in kristalliner Anordnung von Seite zu Seite nur wenig vibrieren können. Die Moleküle sind in der solide Zustand.
Bei höheren Temperaturen ist die kinetische Energie der Partikel höher. Die Teilchen haben genug Energie, um an ihren Nachbarn vorbei zu gleiten. Sie haben nicht genug Energie, um den Attraktionen ihrer Nachbarn zu entkommen. Das System befindet sich im Flüssigkeit Zustand.
Bei hohen Temperaturen ist die kinetische Energie der Partikel hoch. Die Partikel können den Anziehungskräften ihrer Nachbarn entkommen und sich nach Belieben innerhalb des Behälters bewegen. Das System befindet sich im Gas Zustand.