Wie kann ich feststellen, ob und wann ein Molekül eine Resonanzstruktur aufweist oder benötigt?
Antworten:
Ein Molekül kann Resonanzstrukturen aufweisen, wenn es ein einzelnes Paar oder eine Doppelbindung am Atom neben einer Doppelbindung aufweist.
Erläuterung:
Wann immer Sie zwei oder mehr Lewis-Strukturen für ein Molekül zeichnen können, die sich nur in den Positionen der Elektronen unterscheiden, ist die tatsächliche Struktur keine der Strukturen, sondern eine Resonanz Hybrid von allen.
Was ist zum Beispiel die Lewis-Struktur des Nitritions NO₂⁻?
1. Entscheide, welches das zentrale Atom in der Struktur ist. Dies ist normalerweise das am wenigsten elektronegative Atom (N).
2. Zeichnen Sie eine Gerüststruktur, in der die anderen Atome einfach an das Zentralatom gebunden sind: ONO.
3. Zeichnen Sie eine Versuchsstruktur, indem Sie Elektronenpaare um jedes Atom legen, bis jedes ein Oktett erhält. In diesem Editor muss ich es schreiben als :: Ö-N (::) - Ö ::
4. Zähle die Valenzelektronen in Ihrer Teststruktur (20).
5. Nun zähle die Valenzelektronen Sie haben tatsächlich zur Verfügung.
1 N + 2 O + 1 = 1 × 7 + 2 × 6 + 1 = 18.
Die Versuchsstruktur enthält zwei Elektronen mehr als verfügbar sind.
6. Zeichnen Sie eine neue Versuchsstruktur, und fügen Sie diesmal für jedes zusätzliche Elektronenpaar eine Doppelbindung ein: ON = O und O = NO (zwei Möglichkeiten) - Hier sagen uns die beiden Möglichkeiten, dass wir zwei Resonanzstrukturen haben werden.
7. Addiere wie zuvor Valenzelektronen, um jedem Atom ein Oktett zu geben:
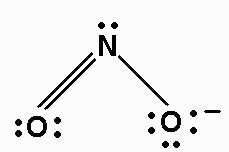
8. Ordnen Sie jedem Atom formale Ladungen zu.
Jedes Atom "besitzt" seine Elektronenpaare und die Hälfte der gemeinsamen Paare.
Das rechte O-Atom enthält 6-Elektronenpaare plus 1 aus der Einfachbindung. Dies ist ein Elektron mehr als in einem isolierten O-Atom. Die offizielle Gebühr für O ist also -1.
Die beiden Resonanzstrukturen sind:

Die tatsächliche Struktur ist keine davon. Es ist ein Resonanz-Hybrid von beiden.


