Wie kann ich die Bindungsordnung von Benzol berechnen?
Sie zeichnen die Molekülorbitale. Dann addieren Sie Elektronen und zählen die Anzahl von Kleben und antibindende Elektronen.
Die Bindungsreihenfolge einer Bindung ist die Hälfte der Differenz zwischen der Anzahl der bindenden und antibindenden Elektronen.
BO = 1/2 (B - A)
Die CC σ-Anleihen
Jede CC σ-Bindung ist eine lokalisierte Bindung. Es hat 2-Bindungselektronen und 0-Nichtbindungselektronen.
σBO = 1/2 (B - A) = 1/2 (2 - 0) = 1
Die CC π-Anleihen
Benzol hat 6-Molekül-π-Orbitale.
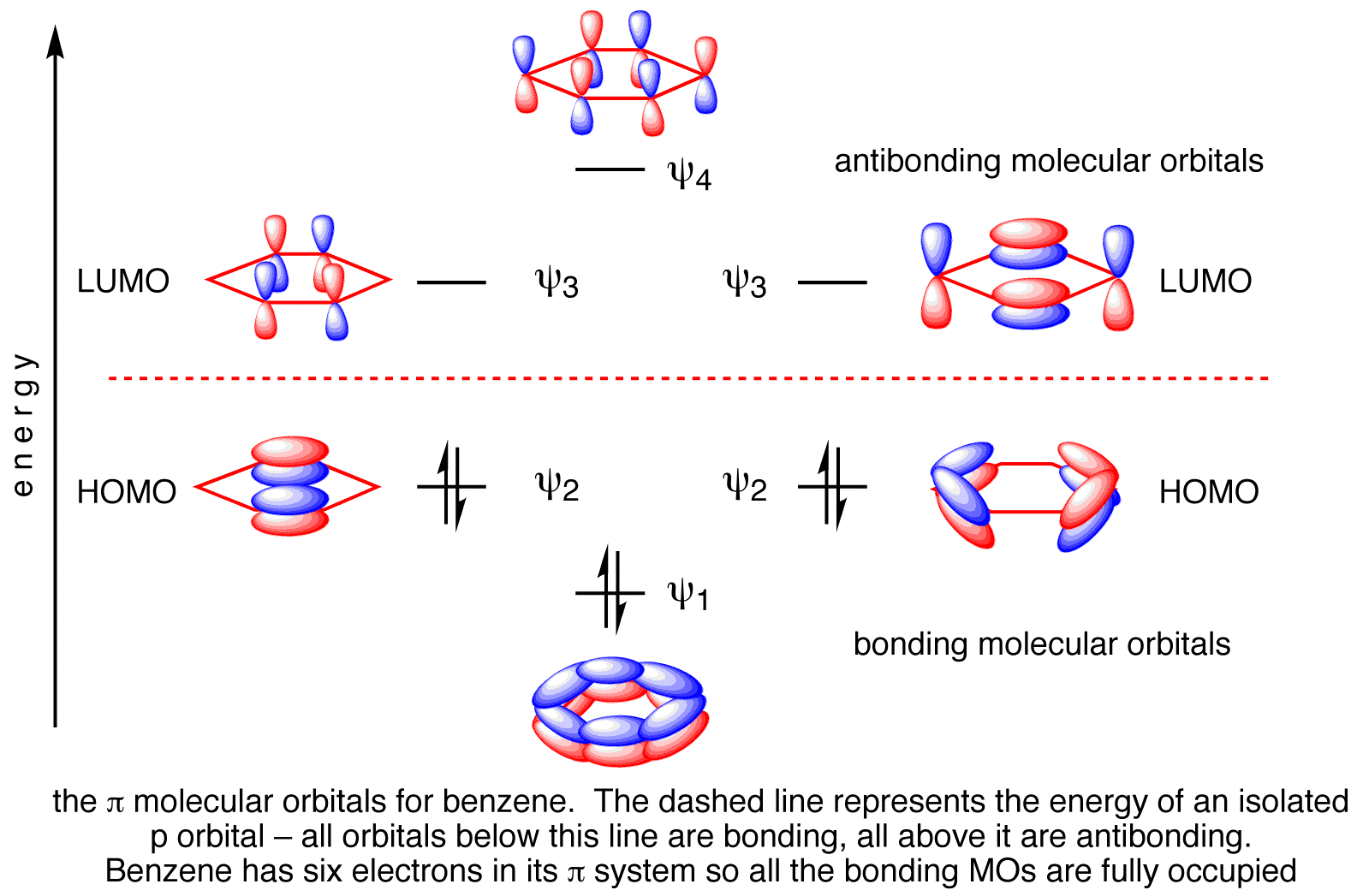
Davon binden drei und drei antibinden. Die sechs π-Elektronen gehen in die drei Bindungsorbitale.
πBO = ½ (B - A) = ½ (6 - 0) = 3
Dies ist die π-Bindungsreihenfolge für 6 CC-Bindungen.
Für eine CC π-Bindung ist BO = 3 / 6 = 0.5.
Für eine einzelne CC-Bindung in Benzol ist die Summe BO = σ + π = 1 + 0.5 = 1.5.

