Wie fülle ich bindende und antibindende Orbitale?
Sobald Sie Molekülorbitale gezeichnet und markiert haben, füllen Sie sie in der gleichen Reihenfolge wie Atomorbitale.
Die Regeln, nach denen Sie Atomorbitale füllen, sind:
1. Aufbau Prinzip
Sie platzieren Elektronen in die Orbitale mit der niedrigsten verfügbaren Energie.
2. Pauli-Ausschlussprinzip
Kein Orbital darf mehr als zwei Elektronen enthalten, und sie müssen entgegengesetzten Spin haben.
3. Hunds Regel
Jedes Orbital in einer Unterschale darf nur ein Elektron enthalten, bevor ein Orbital zwei Elektronen haben kann. Alle Elektronen in einzeln besetzten Orbitalen müssen den gleichen Spin haben.
Sie verwenden die gleichen Regeln, um Molekülorbitale zu füllen.
Wenden wir dies auf das Molekülorbitaldiagramm von Sauerstoff an.
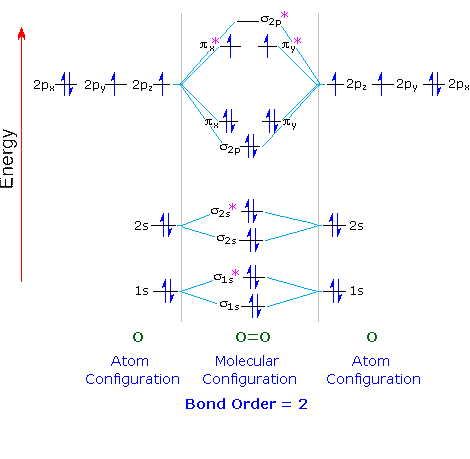
Jedes O-Atom enthält 8-Elektronen, so daß wir 16-Elektronen haben, die in die Molekülorbitale von O & sub2; eingebaut werden.
Wir setzen zwei Elektronen in jeden der σ1s, σ1s, σ2s, σ2sund & sgr; 2p (10-Elektronen).
Die nächsten vier Elektronen folgen der Hund'schen Regel und gehen in der richtigen Reihenfolge in die #π_x#, #π_y#, #π_x#, und #π_y# Orbitale.
Die verbleibenden zwei Elektronen folgen der Hundschen Regel und gehen in der richtigen Reihenfolge in die #π_x^"*"# und #π_y^"*"# Orbitale.
Ein Sauerstoffmolekül hat zwei ungepaarte Elektronen.

