Wie bestimme ich die Hybridisierung und Bindung in Ammoniak?
Antworten:
Hier ist, wie es geht.
Erläuterung:
Sie zeichnen die Lewis-Struktur (Schritt 1) und verwenden VSEPR Theorie zur Bestimmung seiner Elektronendomänengeometrie als Tetraeder und seiner Molekülform (Stufe 2) als trigonale Pyramide.
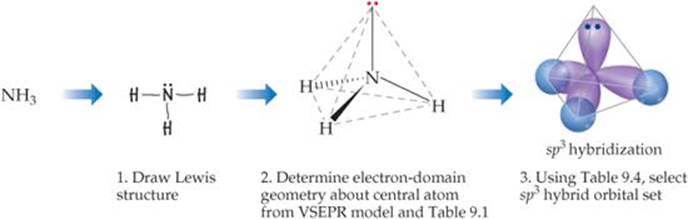
Dann konsultieren Sie eine Tabelle wie die folgende.

(Angepasst von SlideShare)
Sie finden, dass die #"N"# Atom verwendet #"sp"^3# Orbitale, so dass Sie vier Tropfenformen zeichnen, die in Richtung der Ecken eines Tetraeders zeigen (Schritt 3).
Die #"H"# Atome nutzen ihre #"1s"# Orbitale für KlebenSie zeichnen also kleine Kreise, die sich mit drei der #"sp"#3-Orbitale.
Das zeigt, dass die #"N-H"# Bindungen sind σ-Bindungen, die durch die Überlappung von gebildet werden #"sp"^3# Orbitale von #"N"# und #"1s"# Orbitale von #"H"#.
Die Molekülorbitale umfassen jedoch beide #"N"# und #"H"# Kerne.

Im obigen Diagramm zeigt die Bondlinienzeichnung, dass die #"H"# Die Kerne befinden sich vollständig in der größeren tropfenförmigen Form #"sp"^3"-s"# σ Molekülorbitale.

