Welche Prioritätsreihenfolge haben Faktoren wie Resonanz, Hybridisierung, Solvatisierung usw. bei der Bestimmung der relativen Azidität oder Basizität von Verbindungen in einer Liste?
Antworten:
WARNUNG! Lange Antwort! Hier sind meine Gedanken.
Erläuterung:
Alles was das mindert #"X-H"# Die Bindungsstärke in der Säure oder die Stabilisierung der Konjugatbase erhöht die Azidität und verringert die Basizität der Konjugatbase.
Ich würde die Faktoren in der Reihenfolge 1 identifizieren. #bb"R"#Esonanz; 2. #bb"A"#tom; 3. #bb"D"#ipole #bb"I""#induktive Wirkung; 4. #bb"O"#rbitals (#bb"RADIO"#).
Starke Säuren
Es gibt sechs übliche starke Säuren. In der Reihenfolge der Erhöhung des Säuregehalts sind dies:
#"HNO"_3 < "H"_2"SO"_4 < "HCl" < "HBr" < "HI" < "HClO"_4#
Jede starke Säure ist stärker als die meisten organischen Säuren.
Einige zu berücksichtigende Faktoren sind:
1. Resonanz
Ich habe die Resonanzstabilisierung des Anions an die erste Stelle der Liste gesetzt.
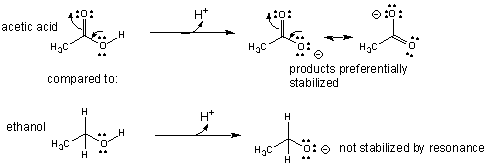
Je mehr Resonanzfaktoren eine konjugierte Base hat, desto stärker ist die Säure.
Das erklärt teilweise, warum Schwefelsäure stärker ist als Salpetersäure.
Es erklärt auch, warum Essigsäure (#"p"K_"a" ≈5#) ist eine stärkere Säure als
Ethanol (#"p"K_"a" ≈ 16#).
2. Atom
(ein) Die Säure von HX steigt von links nach rechts an das Periodensystem.
#color(white)(mmml)"CH"_4 < color(green)("N")"H"_3 < color(red)("H")_2"O" < "H"color(lime)("F")#
#"p"K_"a"color(white)(m)~50color(white)(mmll)38color(white)(mml)15.7color(white)(mm)3.2#
Da die Elektronegativität of #"X"# Erhöht die Kleben Elektronen werden näher zu gepulst #"X"# und der Säuregehalt steigt an.
Die Ausnahme ist #"HF"#, wofür die konjugierte Base #"F"^"-"# wird durch Solvatisierung durch Wassermoleküle stabilisiert.
(B) Die Säure steigt von oben nach unten im Periodensystem an.
#color(white)(mmml)"HF" < "HCl" < "HBr" < "HI"#
#"p"K_"a"color(white)(ml)3.8color(white)(mll)"-8.0"color(white)(mm)"-9.0"color(white)(mll)"-10"#
Wenn Sie in einer Gruppe nach unten gehen, wird die Bindungslänge länger und schwächer und die Ladung Dichte auf das Ion sinkt.
3. #bb"D"#ipoles und #bb"I"#induktive Effekte
Elektronegative Atome ziehen eine negative Ladung auf sich.
Dies schwächt die HX-Bindung und stabilisiert die konjugierte Base.
Die Wirkung nimmt mit zunehmender Entfernung vom Säurebildner ab #"H"# Atom.

(Aus SlidePlayer)
Alkylgruppen sind elektronenspendende Gruppen.
Sie drücken die Elektronendichte auf die #"COOH"# gruppieren und destabilisieren das Carboxylation.
Je mehr Alkylgruppen vorhanden sind, desto schwächer ist die Säure.
4. Orbitale
Die mehr #"s"# Charakter in einem Orbital, je näher die Elektronen an den Kern sein.
Da gehen wir ab #"sp"^3# (Alkan) zu #"sp"^2# (Alken) zu #"sp"# (Alkin-) Hybridisierung erhöht sich die Stabilität der negativen Ladung.
Alkine sind im Vergleich zu Alkanen bemerkenswert sauer.

Hier ist eine Zusammenfassung der Diskussion.

