Was sind die Haupt- und Nebenresonanzfaktoren für das Azidanion #N_3 ^ - #?
Die Schritte zum Zeichnen der Lewis-Strukturen sind:
1. Schreiben Sie alle möglichen Verbindungen für die Stickstoffatome.
NNN
2. Berechnen#V#die Anzahl der Valenzelektronen Sie haben tatsächlich zur Verfügung.
#V# = 3 N + 1 = 3 × 5 + 1 = 16.
3. Berechnen #P#muss die Anzahl der π-Elektronen im Molekül sein:
#P = 6n + 2 – V#
woher #n# ist die Anzahl von Nicht-Wasserstoffatome im Molekül.
#P# = 6 × 3 + 2 - 16 = 4 π Elektronen. Es gibt also entweder zwei Doppelbindungen oder eine Dreifachbindung.
4. Neue Strukturen zeichnen.
Dieses Mal fügen Sie die Doppel- und Dreifachbindungen in allen möglichen Kombinationen ein.
5. Addiere Valenzelektronen, um jedem Atom ein Oktett zu geben.
6. Berechnen Sie die formale Ladung für jedes Atom.
Am Ende haben wir 3-Möglichkeiten.
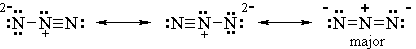
7. Identifizieren Sie den Hauptverantwortlichen.
Alle drei Strukturen haben Ladungstrennung.
Die ersten beiden Strukturen haben eine Ladung von 2- an einem N-Atom. Die dritte Struktur hat eine Ladung von -1 an zwei getrennten N-Atomen.
Der stabilste Mitwirkende hat die größte Verlagerung oder Ausbreitung außerhalb der Kosten.
Die ersten beiden Strukturen liefern also nur geringe Beiträge, und die dritte Struktur liefert den größten Beitrag.

