Was ist die Bindungspolarität von h2o?
Die Bindungspolarität bezieht sich auf die Ladungstrennung innerhalb einer Bindung.
Bindungen zwischen Atomen verschiedener Elektronegativität sind polar. Das elektronegativere Atom hat ein höheres Dichte of Kleben Elektronen um ihn herum, wodurch er eine teilweise negative Ladung erhält (δ⁻). Dem weniger elektronegativen Atom wird ein Teil seiner Elektronendichte entzogen, wodurch es eine teilweise positive Ladung erhält (δ⁺).
In Wasser ist die Ladungstrennung in den OH-Bindungen auf die unterschiedlichen Elektronegativitäten von Sauerstoff und Wasserstoff zurückzuführen. Da Sauerstoff elektronegativer als Wasserstoff ist, ist eine OH-Bindung polar kovalent. Jede OH-Bindung ist polar kovalent mit einer teilweise negativen Ladung am Sauerstoffatom.
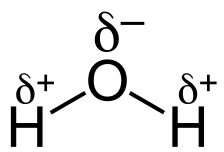
Die Polarität in den Bindungen ist auch durch einen Pfeil dargestellt, der einen Dipol darstellt (zwei Ladungen, die durch einen Abstand voneinander getrennt sind). Am Ende des Pfeils befindet sich ein +. Die Pfeilspitze zeigt mit dem Pluszeichen auf das δ⁻-Atom. Wasser hat also zwei OH-Bindungsdipole, die jeweils zum O-Atom zeigen.


