Was ist das Molekülorbitaldiagramm für # B_2 #?
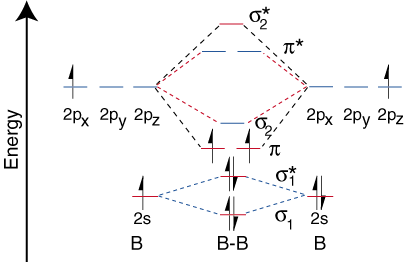
Bevor wir ein Molekülorbitaldiagramm für B & sub2; zeichnen können, müssen wir die In-Phase- und Out-Phase-Überlappungskombinationen für Bor-Atomorbitale finden.
Dann ordnen wir sie nach zunehmender Energie.
Wir können das ignorieren #1s# Orbitale, weil sie keine Valenzelektronen enthalten.
Jedes Boratom hat eines #2s# und drei #2p# Valenzorbitale.
Die #2s# Orbitale überlappen sich zu bilden #2sσ# und #2sσ"*"# Orbitale.
Die #2p_x# Orbitale können sich endständig überlappen und bilden #2pσ# und #2pσ"*"# Orbitale.
Die #2p_y# und #2p_z# Orbitale können sich seitlich überlappen, um degenerierte Paare von zu bilden #2pπ# und #2pπ"*"# Orbitale.
Die Reihenfolge der Energien ist #2sσ < 2sσ^✳ < 2pπ < 2pσ < 2pπ^✳ < 2pσ^✳#.
Wir haben drei Valenzelektronen von jedem B-Atom, also wird B & sub2; sechs Valenzelektronen haben.
Wir verwenden das Pauli-Ausschlussprinzip und die Hundsche Regel, um die Orbitale in einem Aufbauprozess zu füllen.
Das Molekülorbitaldiagramm für B & sub2; wird dann
Das folgende Video beschreibt, wie aus den Elementen der Zeile 2 des Periodensystems Molekülorbitaldiagramme für B & sub2; und andere zweiatomige Moleküle erzeugt werden.

