Was ist das Dipolmoment von Stickstofftrichlorid?
Das Dipolmoment von NCl & sub3; ist 0.6 D.
Die Lewis-Struktur von NCl₃ ist
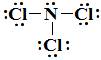
Hat drei einzelne Paare und ein Bindungspaar. Das macht es zu einem AX₃E-Molekül.
Die vier Elektronendomänen ergeben eine tetraedrische Elektronengeometrie. Das einzige Paar macht die Molekülform zu einer trigonalen Pyramide.
N und Cl haben fast genau die gleichen Elektronegativitäten. Der Elektronegativitätsunterschied ist so gering, dass die N-Cl-Bindungen unpolar sind.
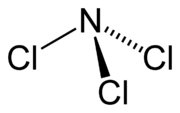
Woher kommt also der Dipol-Moment? Antwort: das einsame Paar.
Ein einzelnes Paar trägt zu einem Dipolmoment bei. Theoretische Berechnungen zeigen, dass der Beitrag eines einzelnen sp³-Paares zu Stickstoff so groß sein kann wie 1.3 D.
Es ist also vernünftig, dass das Dipolmoment von NCl & sub3; 0.9 D ist.

