Warum ist O2 paramagnetisch?
Antworten:
#"O"_2# ist paramagnetisch, weil es zwei ungepaarte Elektronen hat.
Erläuterung:
Die Lewis-Struktur von #"O"_2# gibt einen irreführenden Eindruck.

Es zeigt, dass alle Elektronen im Sauerstoff gepaart sind, also sollte Sauerstoff sein diamagnetisch.
Und doch Sauerstoff is paramagnetisch.
Die richtige Erklärung kommt von Molekülorbitaltheorie.
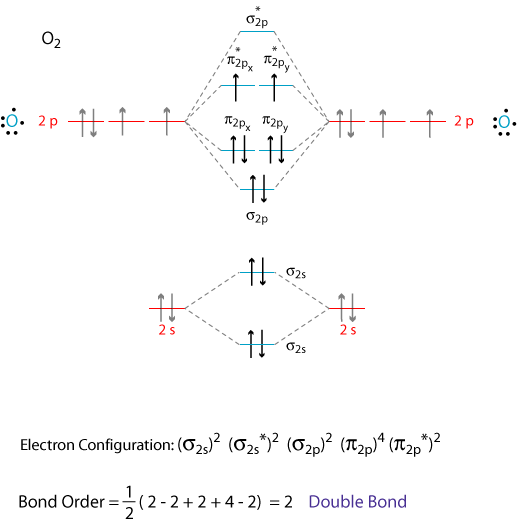
Die Atomorbitale der #"O"# Atome überlappen sich und bilden die σ - und π - Orbitale der #"O"_2# Molekül wie im obigen Diagramm gezeigt.
Wir addieren die 12 - Valenzelektronen nach dem Aufbau Prinzip.
Die letzten beiden Elektronen gehen nach in getrennte, entartete π-Orbitale über Hunds Regel.
Somit hat Sauerstoff zwei ungepaarte Elektronen und ist paramagnetisch.

