Warum ist die Hydrierungswärme von Benzol geringer als erwartet?
Antworten:
Die Hydrierungswärme ist geringer als erwartet, da Benzol durch stabilisiert wird Resonanz.
Erläuterung:
Hitze der Hydrierung
Cyclohexen hat eine Doppelbindung und seine Hydrierungswärme beträgt -120 kJ / mol.
Benzol hat drei Doppelbindungen, so dass wir erwarten können, dass seine Hydrierungswärme -360 kJ / mol beträgt.

Die gemessene Hydrierungswärme beträgt jedoch nur -208 kJ / mol.
Benzol ist stabiler als von 152 kJ / mol erwartet. Dieser Unterschied wird als sein bezeichnet Resonanzenergie.
Resonanz

Wir können zwei Lewis-Strukturen für Benzol schreiben, die sich nur in der Position der Elektronen unterscheiden.
Wann immer wir dies tun können, ist die richtige Struktur keine der beiden. Es ist ein Resonanz-Hybrid von ihnen beiden.
Eine solche Struktur ist stabiler als jeder der Mitwirkenden, und die zusätzliche Stabilisierung wird als bezeichnet Resonanzenergie der Verbindung.
Die Erklärung der Umlaufbahn
Wir können dies anhand der beteiligten Orbitale verstehen.
Die Kohlenstoffatome in Benzol sind #"sp"^2# hybridisiert und die nicht hybridisiert #"p"_z# Orbitale überlappen sich seitlich und bilden die π-Wolken der #"C=C"# Doppelbindungen.
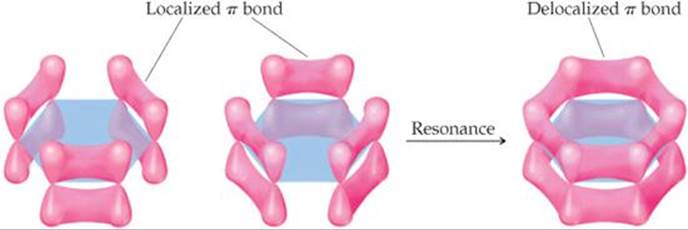
Alle sechs #"p"# Orbitale können sich seitlich überlappen, um eine "delokalisierte" π-Elektronenwolke um den Ring zu bilden.
Wenn sich Elektronen ausbreiten oder "delokalisieren" können, sind sie auf einem niedrigeren Energieniveau.
Die Überlappung scheint in der obigen Abbildung gering zu sein.

(Angepasst von Physics Stack Exchange)
Das obige Computerbild zeigt dies jedoch #"2p"# Orbitale sind sehr viel "dicker" als die langgestreckten Tränenformen, die wir normalerweise zeichnen, und die Kohlenstoffatome sind nahe genug beieinander, so dass eine seitliche Überlappung der Orbitale ziemlich bedeutend ist.

