Enthalten alle folgenden Moleküle mindestens einen Bindungswinkel bei 120-Grad: SeS3, SeS2, PCl5, TeCl4, ICI3 und XeCl2?
Antworten:
Nein, da zwei der Moleküle bei 120 ° keine Bindungswinkel haben.
Erläuterung:
Um diese Frage zu beantworten, müssen Sie die Lewis-Strukturen der Verbindungen zeichnen und ihre VSEPR-Formen bestimmen.
#"SeS"_3#
Die Lewis-Struktur von #"SeS"_3# is

(Ab www.homeworklib.com)
Das ist ein #"AX"_3# Molekül und seine Geometrie ist trigonal planar.
Alle Bindungswinkel in einem trigonalen planaren Molekül betragen ungefähr 120 °.
#"SeS"_2#
Die Lewis-Struktur von #"SeS"_2# is
#:stackrel(". .")("S")=stackrel(". .")("Se")=stackrel(". .")("S"):#
Das ist ein #"AX"_2"E"# Molekül.
Seine Elektronengeometrie ist trigonal planar.
Der Bindungswinkel in einem #"AX"_2"E"# Molekül ist ungefähr 120 °.
#"PCl"_5#
Die Lewis-Struktur von #"PCl"_5# is
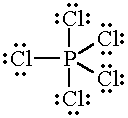
Das ist ein #"AX"_5# Molekül und seine Geometrie ist trigonal pyramidal.
Die äquatorialen Bindungswinkel in einem trigonalen bipyramidalen Molekül betragen alle 120 °.
#"TeCl"_4#
Die Lewis-Struktur von #"TeCl"_4# is

Das ist ein #"AX"_4"E"# Molekül.
Seine Elektronengeometrie ist trigonal pyramidal.
Der äquatoriale Bindungswinkel zwischen dem Äquator #"Te-Cl"# Bindungen ist ungefähr 120 °.
#"ICl"_3#
Die Lewis-Struktur von #"ICl"_3# is
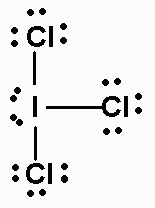
Das ist ein #"AX"_3"E"_2# Molekül.
Seine Elektronengeometrie ist trigonal-pyramidenförmig und seine Molekülgeometrie ist T-förmig.
Die #"I-Cl"# Die Bindungswinkel in einem T-förmigen Molekül betragen beide ungefähr 90 °.
#"XeCl"_2#
Die Lewis-Struktur von #"XeCl"_2# is
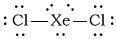
Das ist ein #"AX"_2"E"_3# Molekül.
Seine Elektronengeometrie ist trigonal-pyramidenförmig, wobei sich die einzelnen Paare in äquatorialen Positionen befinden.
Das Molekül ist linear mit a #"Cl-Xe-Cl"# Bindungswinkel von 180 °.

