Welche konjugierten Basen deprotonieren Wasser?
Antworten:
Die konjugierte Base einer beliebigen Säure mit a #pK_"a"# Größer als Wasser wird Wasser deprotonieren.
Erläuterung:
Hier ist eine kurze #pK_"a"# Tabelle.
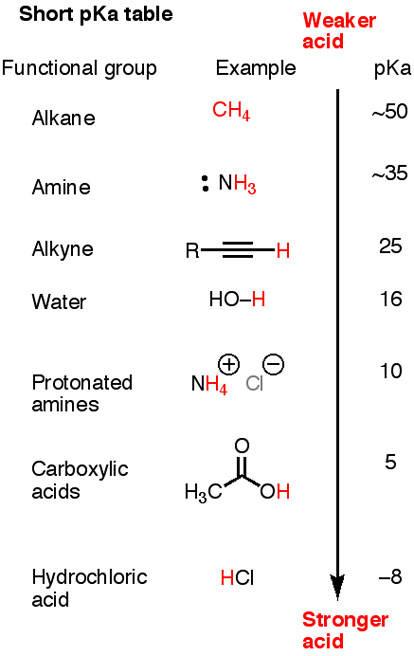
Beachten Sie, dass #"HC≡C-H", "H"_2"N-H"#, und #"H"_3"C-H"# sind alle schwächere Säuren als Wasser.
Die entsprechenden konjugierten Basen, #"H-C≡C:"^"-", "H"_2"N:"^"-"#, und #"H"_3"C:"^"-"#, sind stark. Sie werden alle Wasser deprotonieren.
Die konjugierte Base von Methan #"H"_3"C:"^"-"# ist stark genug, um alles darunter in der Tabelle zu deprotonieren.
Methyllithium, #"CH"_3"Li"#ist eine der stärksten Basen.
Acetylidion (#"H-C≡C:"^"-"#) ist stark genug, um nur eine Säure mit a zu deprotonieren #"pK"_"a" < 25#.
Acetat-Ion (#"CH"_3"COO"^"-"#) ist noch schwächer und kann nur eine Säure mit a deprotonieren #pK_a < 5#.
Eine vollständigere Tabelle von #pK_"a"# Werte geben Ihnen viel mehr konjugierte Basen, die Wasser deprotonieren.

